Redox Biology:ALOX15B通过脂质过氧化、ERK1/2和SREBP2控制巨噬细胞胆固醇稳态
- 发布时间: 2024-4-28
多不饱和脂肪酸(PUFAs)的过氧化是由自由基或脂氧合酶(LOXs)非酶促引发的。LOXs是一个异构的非血红素含铁双加氧酶家族,它通过在(1Z, 4Z)戊二烯部分插入分子氧,催化PUFAs的立体特异性过氧化成相应的氢过氧衍生物。
人类基因组编码6个功能性LOX基因,包括2个在碳原子15处氧合花生四烯酸的15-LOX,分类为花生四烯酸15-脂氧合酶(ALOX15)和花生四烯酸15-脂氧合酶B型(ALOX15B)。ALOX15在未受刺激的原代人巨噬细胞中不存在,其诱导严格依赖于T辅助细胞2型细胞因子白介素和/或白介素,而ALOX15B在信使RNA和蛋白质水平上均有组成性表达。
虽然ALOX15B的生物学功能尚未完全表征,但越来越多的数据表明ALOX15B在细胞脂质稳态中起作用。在原代人巨噬细胞中,alox15b缺失可减少动脉粥样硬化中的脂质积累和炎症。此外,抑制巨噬细胞ALOX15B会限制甾醇调节元件结合蛋白(SREBP) 2的信号传导,SREBP 2是内源性胆固醇生物合成的主要转录因子。

图片来源:https://doi.org/10.1016/j.redox.2024.103149
近日,来自法兰克福歌德大学的研究者们在Redox Biology杂志上发表了题为“ALOX15B controls macrophage cholesterol homeostasis via lipid peroxidation, ERK1/2 and SREBP2”的文章,该研究揭示了ALOX15B通过脂质过氧化、ERK1/2和SREBP2控制巨噬细胞胆固醇稳态。
巨噬细胞胆固醇稳态对健康和疾病至关重要,并且与脂质过氧化酶花生四烯酸15-脂氧合酶B型(ALOX15B)有关,尽管分子机制尚不清楚。研究者对alox15b沉默的原代人巨噬细胞进行了全局转录组和免疫荧光分析,观察到核固醇调节元件结合蛋白(SREBP) 2的减少,SREBP 2是细胞胆固醇生物合成的主要转录因子。
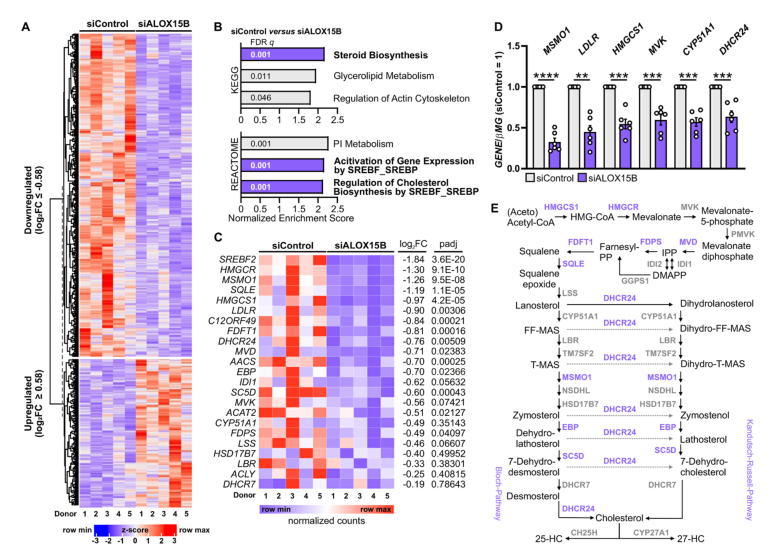
在原代人巨噬细胞中沉默ALOX15B可降低SREBP2依赖性基因表达和核SREBP2蛋白
图片来源:https://doi.org/10.1016/j.redox.2024.103149
因此,srebp2靶基因表达减少,甾醇生物合成中间体去氨甾醇和胆甾醇以及25-和27-羟基胆固醇也减少。从机制上讲,抑制ALOX15B减少了原代人巨噬细胞的脂质过氧化,从而减弱了丝裂原活化蛋白激酶ERK1/2的活化,从而降低了SREBP2的丰度和活性。
低核SREBP2使得alox15b沉默和erk1 /2抑制的巨噬细胞在阻断NPC细胞内胆固醇转运蛋白1时,都难以激活SREBP2。这些研究表明,控制巨噬细胞胆固醇稳态的调节机制是基于alox15b介导的脂质过氧化和伴随的ERK1/2激活。
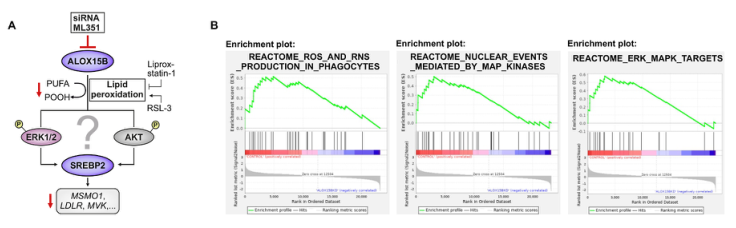
在alox15b抑制的巨噬细胞中,ERK1/2和AKT作为潜在的信号中枢,可降低SREBP2的激活
图片来源:https://doi.org/10.1016/j.redox.2024.103149
本研究提供的证据表明,在原代人巨噬细胞中抑制ALOX15B可减少srebp2依赖性基因的表达,并通过限制丝裂原活化蛋白激酶(MAPK) ERK1和ERK2 (MAPK3和MAPK1)的活化,减少脂质过氧化作用,从而降低甾醇中间体和氧固醇的数量。这突出了脂质过氧化、ERK1/2激活和SREBP2信号在原代人巨噬细胞中的作用,并将该信号轴与ALOX15B活性联系起来。
抑制原代人巨噬细胞ALOX15B通过降低细胞脂质过氧化、ERK1/2信号传导和SREBP2靶基因表达,损害SREBP2依赖性胆固醇的生物合成。这减少了胆固醇前体以及胆固醇衍生的氧化甾醇的数量。未来的研究将探索ALOX15B在影响人巨噬细胞生物学中胆固醇稳态的相关性。(生物谷 Bioon.com)
参考文献:
Yvonne Benatzy et al. ALOX15B controls macrophage cholesterol homeostasis via lipid peroxidation, ERK1/2 and SREBP2. Redox Biol. 2024 Apr 3:72:103149. doi: 10.1016/j.redox.2024.103149.





















